Ons brein is een grote verzameling neuronen die constant geladen deeltjes naar elkaar rondsturen om te communiceren. Hoe is het mogelijk dat die hersencellen samen in staat zijn tot de ingewikkeldste taken? Karl Deisseroth, hoogleraar bio-engineering en psychiatrie aan de Stanford-universiteit in de Verenigde Staten ontwikkelde baanbrekende technieken om – letterlijk – steeds meer licht op deze vraag te werpen. In 2020 ontving hij hiervoor de A.H. Heinekenprijs voor de Geneeskunde.
The English translation of this article can be found here, together with a video about Karl Deisseroth.
Het is een zomerdag in 2007. Een muis scharrelt nietsvermoedend rond in een plastic bak in een laboratorium op de Stanford-universiteit. Via een glasvezelkabeltje in zijn brein zit de muis vast aan een laser, maar zolang deze laser uit staat lijkt hij zich hier niet echt om te bekommeren. Als Karl Deisseroth en collega Feng Zhang de knop van de laser indrukken, begint de muis opeens rondjes te lopen. Continu linksom, als ware hij een langebaanschaatser. Dan gaat de laser uit. De muis scharrelt weer comfortabel rond in zijn plastic bak, alsof er niets gebeurd is.

Zomers warmen sneller op dan winters
Als het klimaat verder opwarmt, zullen de zomers waarschijnlijk sneller opwarmen dan de winters. Dat blijkt uit onderzoek naar schelpen.

Het was een bepalend moment in de carrière van Karl Deisseroth. ‘Toen ik zag dat we ogenblikkelijk het gedrag van een dier konden beheersen, op een precieze, snelle en veilige manier, wist ik dat we echt iets in handen hadden’, vertelt hij. De muis liep zijn rondjes dankzij de optogenetica, een techniek om met licht groepjes zenuwcellen aan te sturen. Het muizenexperiment resulteerde uiteindelijk in een techniek die hersenwetenschappers wereldwijd gebruiken om in detail de activiteit van zenuwcellen van levende zoogdieren te bestuderen. Dit alles om die ene vraag te beantwoorden: hoe komen onze ervaringen, gevoelens en acties voort uit het gedrag van individuele zenuwcellen?
‘Van jongs af aan was ik nieuwsgierig naar de geest’, vertelt Deisseroth. ‘Ik was altijd geïntrigeerd door emoties: waar ze vandaan komen en hoe ze door woorden of ervaringen kunnen worden opgewekt. Aanvankelijk wilde ik schrijver worden, maar op de universiteit raakte ik meer en meer geïnteresseerd in biologie. Ik leerde hoe je ongelooflijk complexe problemen kunt kraken door op celniveau te kijken wat er gebeurt. Deze benadering had de immunologie, kankerbiologie en ontwikkelingsbiologie al getransformeerd. Dat maakte me nieuwsgierig of we dit ook op de hersenen konden toepassen. Wellicht konden we door te kijken op het niveau van zenuwcellen, begrijpen waar gevoelens vandaan komen en wat hun fysieke vorm in de hersenen is.’ Met dit in het achterhoofd ontwikkelde Deisseroth verschillende baanbrekende technieken die ons in staat stellen om met behulp van licht op cellulair niveau naar het brein in actie te kijken, en het zelfs te kunnen beïnvloeden.

Algen-DNA
Voor de eerste techniek, de optogenetica, haalde Deisseroth zijn inspiratie uit de oceaan, en om precies te zijn uit algen. Deze eencelligen zijn van nature gevoelig voor licht. Onder invloed van licht gaan kanaaltjes open in de celwand, waardoor ionen de cel in kunnen stromen. Sommige algensoorten veranderen hierdoor van vorm en bewegen naar het licht toe. Deisseroth kwam op het idee om het stukje DNA dat de code vormt voor het aanmaken van deze lichtgevoelige kanalen, in dierlijke zenuwcellen te implanteren. Als (positieve) natriumionen een zenuwcel binnenstromen, zetten deze het neuron ‘aan’. Negatieve ionen zoals chloride-ionen, zetten een zenuwcel juist uit. Als zenuwcellen dankzij het algen-DNA lichtgevoelige ionenkanaaltjes aanmaken, kun je ze met licht aan- of uitzetten, was de gedachte.
Deisseroth was er niet direct van overtuigd dat dit zou lukken. Er had nog nooit iemand algen-DNA in zenuwcellen van een zoogdier gestopt. Toch lukte het hem al vrij snel om een aantal petrischaaltjes vol zenuwcellen zo ver te krijgen dat ze het algen-DNA opnamen en de ionenkanaaltjes aanmaakten. Vervolgens scheen hij licht op de helft van de petrischaaltjes, de andere helft belichtte hij niet ter controle. ‘Er waren meer geactiveerde neuronen in de belichte schaaltjes dan in de niet-belichte’, zegt Deisseroth. ‘Het effect was klein, maar significant. Op dat moment besefte ik wat er allemaal mogelijk was. De grote vraag was toen: hoe krijgen we dit in het brein van een levend zoogdier?’

Deisseroth maakte gebruik van virussen om de genen bij de zenuwcellen naar binnen te brengen. De grootste moeilijkheid was hier om controle te krijgen over welke cellen het gen wel kregen, en welke niet. ‘Als alle cellen het krijgen heeft het geen zin: je wilt juist een specifiek groepje kunnen aansturen met licht’, legt Deisseroth uit. Na jaren doorontwikkelen lukte het hem om de lichtgevoelige genen in het rechter gedeelte van de motorcortex van een muis te plaatsen, en hier ook een glasvezelkabeltje te implanteren. De rechter motorcortex stuurt beweging naar links aan. Toen Deisseroth en collega Zhang via het glasvezelkabeltje laserlicht op deze zenuwcellen lieten schijnen, werden deze geactiveerd. Hierdoor kon de muis niet anders dan linksom lopen.
Complexe toestanden
Inmiddels is het mogelijk om met licht van een bepaalde golflengte specifieke zenuwcellen aan te zetten, en ze met een andere golflengte uit te zetten. Dit kan in allerlei verschillende zoogdieren, waaronder mensen. Doe je dit terwijl een dier een taak uitvoert of een ervaring beleeft, dan kun je stapsgewijs onderzoeken welke cellen een rol spelen bij welke processen. Je kunt bijvoorbeeld telkens een ander groepje cellen uitzetten terwijl iemand een spannende taak uitvoert, en kijken wat het effect is op onder meer de hartslag en de ademhaling. ‘We passen optogenetica nu toe om te begrijpen hoe complexe toestanden zoals angst worden gecreëerd door de acties van cellen’, aldus Deisseroth.
Als je weet welke zenuwcellen een rol spelen bij deze processen, kun je mensen met bijvoorbeeld een angststoornis specifieker behandelen. ‘In de psychiatrie hebben we veel verschillende soorten medicatie, maar die werken niet in op specifieke celtypen. Daardoor zijn er altijd bijwerkingen. Behandeling met hersenstimulatietechnieken kun je in principe wel steeds preciezer inzetten, maar die precisie kunnen we nog niet ten volle benutten, omdat we nog niet dat diepe begrip hebben van het brein. Het begrip dat uit optogenetica voorktomt, kan dit soort behandelvormen dus beter maken.’

Deisseroth onderzoekt hoe angst, een emotie die hem in het begin van zijn carrière niet vreemd was, is opgebouwd uit verschillende gedeelten in de hersenen. ‘Ik was vroeger heel zenuwachtig voor het geven van presentaties tijdens grote wetenschappelijke congressen. Mijn hart ging tekeer, ik was heel misselijk, had last van zweten en een snelle ademhaling. Naast deze lichamelijke uitingen voelde ik me ook gewoon slecht.’ Met behulp van optogenetica kon Deisseroth jaren later heel precies onderzoeken welke gebiedjes voor deze verschillende onderdelen verantwoordelijk zijn, en hoe deze op elkaar inwerken. ‘Dit resultaat was precies waar ik het meest op had gehoopt’, vertelt Deisseroth. ‘We begrijpen werkelijk hoe onze complexe innerlijke toestanden fysiek in het brein worden samengesteld.’ Op vergelijkbare manier kijkt Deisseroth naar andere complexe toestanden en ziekten, zoals slaap, verslaving, depressie, honger, dorst, parkinson en epilepsie.
Ethische vragen
Het aan- en uitzetten van zenuwcellen biedt prachtige mogelijkheden, maar roept natuurlijk ook ethische vragen op. Denk aan de muis, een zoogdier met een vrije wil dat opeens alleen nog maar rondjes linksom maakt. ‘We kunnen met optogenetica heel precies zaken als agressie, motivatie of geheugen bestuderen, maar ook beïnvloeden’, zegt Deisseroth. ‘Met één druk op de knop kunnen we in de toekomst wellicht het gedrag en de gevoelens van een vrijdenkend mens veranderen. We moeten er goed over nadenken wat wenselijk is en wat niet.’
De eerste directe toepassing van optogenetica in de geneeskunde richt zich op een minder gevoelig onderwerp. ‘De oogwetenschapper Botond Roska, stopte één van onze optogenetische tools in een menselijk netvlies’, vertelt Deisseroth. ‘Na heel veel jaren ontwikkelen, is hij er vorig jaar in geslaagd om een blind persoon op deze manier een beetje zicht terug te geven. Er zijn dus bijzondere toepassingen. Maar ik denk nog steeds dat de grootste impact de in fundamentele wetenschap zit, waardoor we het menselijke brein leren begrijpen.’
Doorzichtige hersenen
De tweede baanbrekende techniek voor hersenonderzoek introduceerde Deisseroth in 2013: hydrogel-tissue chemistry (HTC). Met deze techniek kunnen Deisseroth en zijn collega’s hersenweefsel van overleden dieren en mensen doorzichtig maken. Dit doen ze door de vetachtige stoffen uit de hersenen te verwijderen en te vervangen door een doorzichtige gel. Zo kunnen ze het brein in driedimensionale vorm bestuderen, met alle verbindingen intact, waar de hersenen voorheen altijd in plakjes gesneden moesten worden. Ook kunnen ze fluorescente labels aan specifieke celtypen hangen, waardoor verschillende soorten zenuwcellen in verschillende kleuren oplichten. ‘We kunnen in de individuele zenuwcellen duiken’, zegt Deisseroth, ‘en kijken: waar is deze cel mee verbonden? En belangrijker: welke eiwitten produceert deze cel? Dat geeft samen een hoop informatie over hun functie in het geheel.’
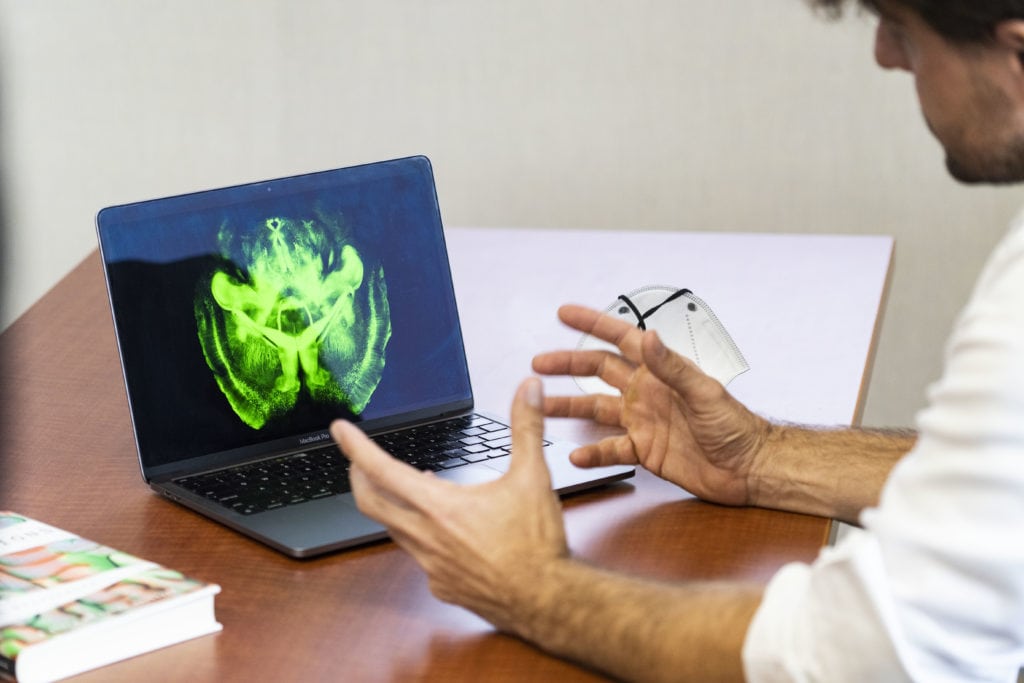
Met HTC kunnen Deisseroth en collega’s afwijkingen detecteren bij specifieke hersenaandoeningen, zoals autisme, epilepsie of alzheimer, en onderzoek doen naar de oorzaken. Bij alzheimer is bijvoorbeeld bekend dat zich klontjes eiwit vormen in de hersenen. Maar hoe deze precies ontstaan, en op wat voor manier ze precies voor problemen zorgen in de neuronen, is nog niet bekend. Daardoor is het ook de vraag waar je een behandeling precies op moet richten. Met behulp van HTC hopen Deisseroth en collega’s meer over het precieze mechanisme op het niveau van individuele cellen te weten te komen.
Som der delen
Het brein bestaat uit een onvoorstelbaar aantal cellen met een duizelingwekkend aantal verbindingen daartussen. Er is dus nog wel wat onderzoek nodig voordat we het brein in al zijn complexiteit kunnen doorgronden. Maar is het in theorie mogelijk om met behulp van optogenetica en HTC het brein ooit volledig te begrijpen, en wellicht zelfs te beheersen? Deisseroth glimlacht. ‘Dit is een van mijn favoriete gespreksonderwerpen. Ik denk daar vaak over na: wat als we elke individuele cel in een menselijk brein kunnen beheersen? Technisch gezien zal het heel lastig worden. Het menselijke brein is gewoonweg te groot om met licht elke individuele cel aan te kunnen sturen. Maar in andere dieren, zoals zebravissen, komen we al in de buurt. Zebravissen zijn doorzichtig en hebben een veel kleiner brein dan wij. Toch lijken hun hersenen verbazingwekkend veel op de onze. En het zou best eens kunnen dat we hier binnenkort op het punt van volledige controle komen.’
Naast de praktische uitdagingen komen er ook filosofische vraagstukken naar boven. Kun je daadwerkelijk al ons gedrag, elke gedachte en elk gevoel volledig beschrijven als een samenstelling van de componenten: de cellen? ‘Deze vraag leidt vrij snel tot een paradox’, zegt Deisseroth. ‘Stel dat je dit kunt doen: je laat een mens naar een mooie dieprode kleur kijken, die een emotie oproept. Je meet precies wat elke zenuwcel doet. Vervolgens haal je de rode kleur weg, en boots je die exacte hersenactiviteit na met optogenetica. De vraag is of die persoon dan hetzelfde gevoel ervaart. Stel dat dat je aanneemt dat dit zo is, dan heeft dat gekke gevolgen.’
‘Als je in elke zenuwcel de hersenactiviteit nabootst, zijn de verbindingen tussen de zenuwcellen eigenlijk niet meer relevant. Normaal gesproken oefenen de cellen via die verbindingen invloed op elkaar uit. De visuele input van de rode kleur in je ogen verspreidt zich dan tot een patroon van activiteit in heel veel verschillende zenuwcellen. Maar wij sturen al die zenuwcellen nu zelf aan met precies datzelfde patroon van activiteit. Dus dan kun je de verbindingen net zo goed weghalen. Sterker nog: je kunt dan ook alle cellen uit het hoofd halen, en over het hele universum verspreiden. Maar als je dat doet: is er dan nog sprake van een mens, die iets voelt? Dit gedachte-experiment geeft aan dat we nog helemaal niet begrijpen wat een subjectieve ervaring nou eigenlijk is.’

CV
Karl Deisseroth (Boston, 1971) studeerde biochemie aan de Harvard-universiteit in de Verenigde Staten en deed een opleiding tot psychiater aan de Stanford-universiteit, eveneens in de VS. Aan diezelfde universiteit promoveerde hij in de neurowetenschappen. Sinds 2012 is hij hoogleraar bio-engineering, psychiatrie en gedragswetenschappen aan de Stanford-universiteit. Daarnaast behandelt hij een dag per week patiënten als psychiater, bij het universitair medisch centrum van Stanford. Hij is tevens als onderzoeker verbonden aan het Howard Hughes Medical Institute in Maryland. Naast de A.H. Heinekenprijs voor de Geneeskunde ontving Deisseroth voor zijn werk onder andere de Breakthrough Prize in Life Sciences, de National Academy of Sciences Lounsbery Award, de Kyoto Prize in Advanced Technology en de Lasker Award in Basic Medical Research.
Onderzoek
Karl Deisseroth ontwikkelt technieken om met behulp van licht de hersenen te bestuderen. Hij onderzoekt hoe complexe toestanden zoals angst, verslaving, epilepsie of depressie samengesteld zijn uit het gedrag van individuele zenuwcellen. Deisseroth ontwikkelde de optogenetica, die het mogelijk maakt om met licht groepjes zenuwcellen aan of uit te zetten. Daarnaast introduceerde hij hydrogel-tissue chemistry, waar de CLARITY- en STARmap-methode bekende onderdelen van zijn. Met deze technieken kunnen hersenonderzoekers hersenweefsel van overleden zoogdieren doorzichtig maken. Op deze manier kunnen hersenonderzoekers alle verbindingen tussen de hersencellen heel precies in kaart brengen. Zo kunnen ze afwijkingen detecteren bij specifieke hersenaandoeningen, zoals autisme, epilepsie en alzheimer.
Heinekenprijzen
Elke twee jaar kent de Koninklijke Nederlandse Akademie van Wetenschappen de Heinekenprijzen toe aan vijf gerenommeerde internationale onderzoekers en één kunstenaar. De eerste van de prijzen, de Dr. H.P. Heinekenprijs voor de Biochemie en Biofysica, werd in 1964 in het leven geroepen door Alfred H. Heineken, als eerbetoon aan zijn vader, dr. Henry P. Heineken. Aan deze prijs werden vervolgens nog Heinekenprijzen voor de Kunst (1988), de Geneeskunde (1989), de Milieuwetenschappen (1990) en de Historische Wetenschap (1990) toegevoegd. De dochter van Alfred Heineken, Charlene L. de Carvalho-Heineken, zet deze traditie voort. Naar haar is de C.L. de Carvalho-Heinekenprijs voor de Cognitieve Wetenschappen (2006) vernoemd.
