Wanneer een bevruchte eicel uitgroeit tot een klompje van cellen, nemen deze cellen stuk voor stuk een belangrijk besluit: worden ze een foetus- of placentacel? Epigeneticus Hendrik Marks bracht dit keuzeproces voor het eerst in kaart met een menselijk ‘nep-embryo’. Daarin bleek de ontwikkeling van cellen te beïnvloeden.
Hoe onderzochten jullie de ‘keuze’ van embryocellen?
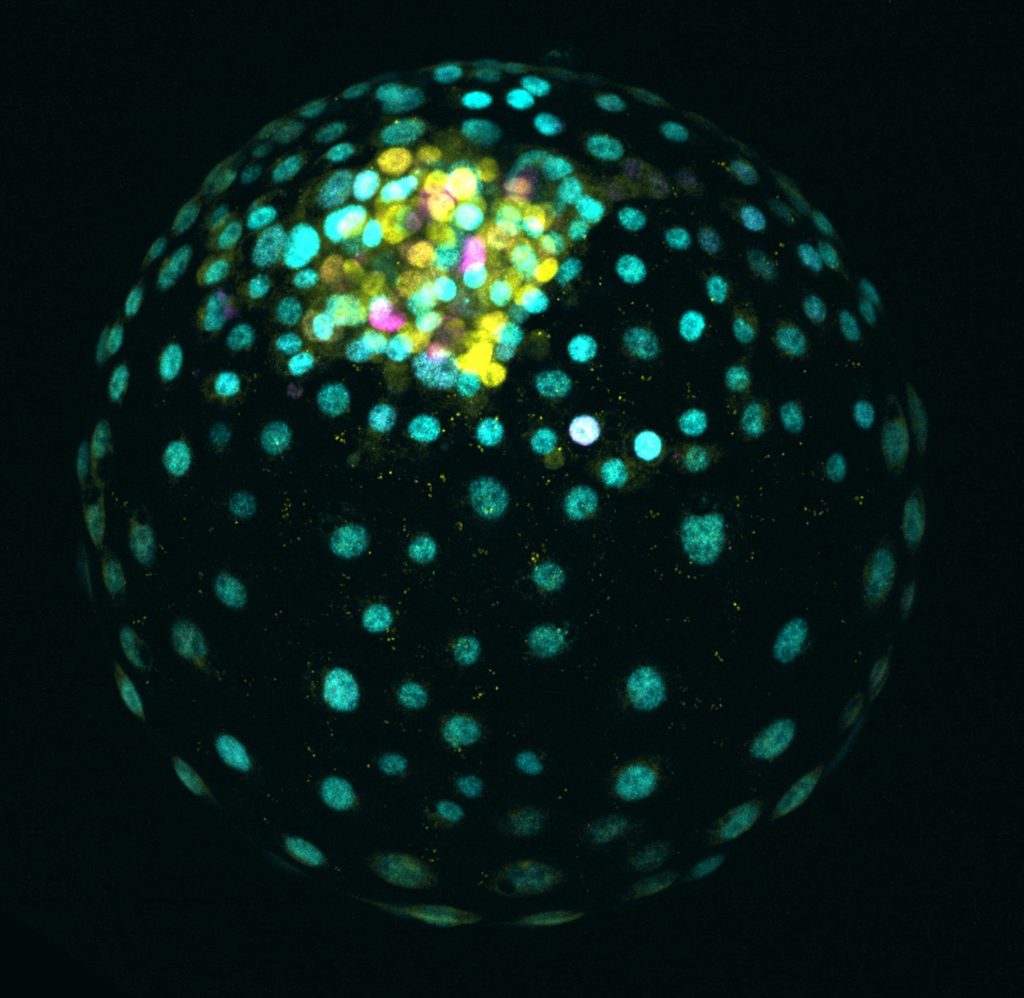
‘Een bevruchte eicel deelt tot een klompje cellen, net zo klein als een A4-tje dik is. De binnenste massa hiervan wordt uiteindelijk een baby. De laag eromheen vormt de placenta. Maar hoe ‘weten’ cellen in dit vroegste klompje of ze placenta- of foetuscel moeten worden? Als deze cellen eenmaal tot foetuscellen ontwikkelen, ligt dat normaal gesproken vast – ze kunnen geen placentacellen meer worden.

Menselijke embryo’s mag je nauwelijks gebruiken. Door embryonale stamcellen samen in een schaaltje te laten uitgroeien tot een nieuw soort modelembryo, konden we deze allereerste beslissing in kaart brengen, zonder echte embryo’s.’

Het darmmicrobioom en chronische ziekten
Het microbioom wordt in verband gebracht met ziekten zoals alzheimer, diabetes en het chronischevermoeidheidssyndroom.
Wat hebben jullie ontdekt?
‘Ons lab onderzoekt wat er op het DNA gebeurt als cellen deze beslissing nemen. Waardoor specialiseert de ene cel zich tot huidcel en de andere zich tot hartcel, terwijl ze hetzelfde DNA hebben? Dat bepalen een soort ‘schakelaartjes’, die delen van het DNA ‘aan’ of ‘uit’ zetten. Dat heet epigenetica. Elke cel kan zo met hetzelfde DNA een ander celtype worden. Zie het als een kookboek: met dezelfde ingrediënten kun je verschillende gerechten maken.
DNA in bevruchte eicellen wordt als origami opgevouwen. Sommige delen zijn strak opgevouwen en sommige juist open. Als een schakelaartje ‘uit’ staat, dan is het DNA zo compact opgerold dat er geen ruimte is om het af te lezen. Als het schakelaartje ‘aan’ staat, dan is het DNA open en wordt het makkelijk afgelezen.
We ontdekten dat bij embryocellen die tot foetuscellen uitgroeiden, het DNA voor placentaformatie geblokkeerd was. Het placenta-DNA was compact opgevouwen: het schakelaartje stond uit.
Wat nog verrassender was: als we zelf een stofje toevoegden, gingen die compacte delen open en ontwikkelden de cellen zich wel tot placentacellen. Dat ging dan ten koste van het aantal foetuscellen. Wij kunnen dus met een simpel stofje die blokkade opheffen. Op die manier kunnen we zelfs foetuscellen ‘terugontwikkelen’ tot embryonale cellen, en ze daarna veranderen in placentacellen.’
Waar leidt dit onderzoek toe?
‘Zulk fundamenteel onderzoek vertaalt lastig naar praktische mogelijkheden, maar het opent wel deuren. Ik kan mij goed voorstellen dat als een embryo in een ivf-kliniek te weinig placentacellen vormt, onze ontdekking dit kan rechttrekken. Misschien krijg je zo wel een gezond embryo.
Daarnaast gebruiken medici soms stamcellen van patiënten om hun organen te helen. Waar haal je die vandaan? Je zou de placenta na de bevalling kunnen opslaan, in plaats van weggooien. Als het kind later stamceltherapie nodig heeft, dan kun je placentacellen terugzetten naar embryonale stamcellen, en die verder ontwikkelen tot bijvoorbeeld hartcellen.’
Bent u niet bang voor misbruik van dit soort modelembryo’s?
‘Er zijn veel wettelijke voorzorgsmaatregelen. Dit embryo-achtige cellenklompje is enkel voor onderzoek: het kan geen mens worden. Het is geen embryo, ook al lijkt het er erg op. Maar het ethische vraagstuk bagatelliseer ik niet. Stel dat uit zo’n model ooit wel foetussen zouden kunnen groeien, dan zullen we een onmisbaar gen deactiveren. Op misbruik moet streng gelet worden. Wij wetenschappers zijn nieuwsgierig, maar er zit een grens aan hoe ver we mogen gaan.’


